開篇宣告:1:以下內容轉自以下內容轉自微信公眾號流行病與衛生統計學《PFS區間刪失的樣本量估計》,如有侵權,可聯絡刪除
2. 以下觀點,僅代表作者個人觀點,請帶著質疑的態度去閱讀。如有問題,歡迎評論區留言或直接聯絡作者
ABSTRACT
無進展生存期(PFS)經常用作腫瘤後期疾病的II和III期研究中的主要終點。 PFS是從入組到疾病進展或死亡的持續時間,以先發生爲準。直到下一次預定評估(區間刪失)或在進展前發生死亡時,才能觀察到疾病進展的實際發生。對數秩檢驗通常用於比較對PFS的治療效果。 PFS的樣本量無需調整區間刪失或考慮到生存的危害比率很可能會使所需功率降低。不幸的是,用於樣本量計算的主要軟體(例如NQueryAdvisor®,SAS®,Pass和East®)沒有此功能。本文中展示的SAS宏集中在這種未滿足的需求。
Key words: survival analysis, progression-free survival, staggered enrollment, power s imulation, timeline projection.
INTRODUCTION
無進展生存期 (PFS) 經常被用作腫瘤晚期疾病II期和III期研究的主要終點。PFS是從入組到疾病進展或死亡的持續時間,以先發生者爲準。在下一次預定評估 (區間刪失) 之前或死亡發生之前,無法觀察到疾病進展的實際發生 (區間刪失) 。例如,如果患者A和B的疾病進展的實際 (未知) 時間分別發生在4.2和5.6個月,並且假設評估每隔一個月進行一次,則觀察到的PFS為6個月。
對數秩檢驗通常用於比較對PFS的治療效果。基於對數秩檢驗的PFS的樣本量,而無需調整區間刪失或考慮到生存的危害比率很可能會使所需的功率降低。不幸的是,樣本量計算的主要軟體(例如,NQuery Advisor,SAS,Pass和East)沒有此功能。由於事件的數量確定了logrank檢驗的功能,在監管環境中,該分析的資料截止日期應由要包括在分析中的事件數量。考慮到要入組的患者數量以及要觀察的事件數量,本文中證明的SAS宏介紹了區間刪失以及TTP和PFS功率模擬中TTP和生存的分佈。該宏還估計何時發生預先指定的事件數量。除了PFS(是連續和區間刪失資料的混合物)外,我們還展示了將此宏的應用擴充套件到連續終點和區間刪失終點。
THE ALGORITHM OF THE MACRO
附錄中的宏中插入了一些註釋。由於空間限制,本節僅說明了宏中重要且更復雜的程式碼。宏包括以下 4 個主要步驟:
1. 生成模擬中指定的所有試驗的資料,包括入組時間、生存期、實際和觀察到的 TTP 和 PFS。
2. 確定每個試驗中預定數量的事件何時發生,並確定觀察是否被刪失。
3. 使用 SAS LIFETEST 程式和 ODS 計算並輸出每個試驗的 PFS 中位數和 logrank p 值。
4. 根據前一步獲得的結果估計功率並預測時間表。
SIMULATION OF STAGGERED ENROLLMENT
臨床試驗的入組率通常會在試驗地點開始時經歷一個類似斜坡的時期(圖1中的區間[0,tA])。然後入組率穩定下來(圖1中的區間(tA,tB))。

SIMULATION OF THE OBSERVED PFS
指數分佈用於模擬TTP和生存的實際事件時間。模擬的實際PFS是這兩個值的最小值。設x為對照組的中位事件發生時間,對照組與試驗組的危險比為h,其中h>1。則對照組的平均值為x / log(2),其中log(·)是自然對數函式。對於指數分佈,中位事件發生時間的百分比改善等於100×(h - 1)%。因此,試驗組的中位數和平均數分別為hx和hx / log(2) 。
SAS 函式 ranexp(⋅) 使用括號中的隨機化種子,生成引數為 1 的指數隨機變數。可以直接證明,對於任何非負 y,y[ranexp(⋅)] 生成平均為 y 的指數隨機變數。此屬性用於生成 TTP 和生存。
所觀察到的PFS的模擬是從模擬生存和模擬觀察到的TTP中的最小值得出的。生存和實際TTP的模擬遵循前面討論的方法。觀察到的TTP可以透過以下方式模擬:
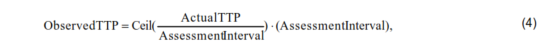
其中 Ceil(⋅) 是大於或等於引數的最小整數。例如,如果實際疾病進展發生在入組後 4.5 個月,並且每 2 個月進行一次評估,則觀察到的 TTP 為 Ceil(4.5/2)x2 = 3x2 = 6(個月)。PFS 的日曆時間為 PFS 加上入組時間。
POWER SIMULATION
資料按每項試驗的 PFS 日曆時間排序,並確定觀察預定事件數量的日曆時間。在此時間點之後入組的患者在每項試驗中被淘汰。對於其餘患者,在此截止時間之後觀察到的 PFS 在截止時間被剔除。所得資料用於使用 LIFETEST 程式計算每項試驗的雙側對數秩 p 值和觀察到的 PFS 中位數。估計的功率是 p 值小於或等於顯著水平的試驗數量的比例。

EXAMPLES
EXAMPLE 1
宏還使用Schoenfeld(1982)公式生成了連續資料所需事件的數量。
使用Sschoenfeld公式中的事件數量,此示例驗證了宏對連續資料模擬的功率是否會產生預期功率。此示例還顯示瞭如何將宏應用到連續資料。該宏以TTP的提高50%(危險比= 1.5),一對一的隨機分配,功率90%,雙側顯著性水平為0.05。使用Schoenfeld的公式為256所需事件的數量。爲了驗證這一數量的事件是否可以透過宏觀實現90%的功率,我們還使用256名0脫落率的患者。換句話說,所有患者都將遵循直到進展。
評估區間分配一個小數值 (0.0001) ,以便觀察到的 TTP 成為連續的。對照組和試驗組的中位總生存期分配兩個大數值,使得模擬的 PFS 與連續 TTP 相同。使用 2000 次試驗,估計功率和 95% 置信區間分別為 0.897 和 (0.875、0.919) 。
在中位 TTP 等於 10 的情況下,達到 256 個事件的平均時間相當長 (128.42) ,置信區間很寬 (97.58,186.19) 。這是因為指數分佈的長尾。由於空間限制,SAS 輸出不會顯示。
EXAMPLE 2
假設一項臨床試驗旨在檢測 PFS 的差異,其中 TTP 的中位為 14 個月對 20 個月,中位生存期為 56 個月對 62 個月。每 12 周 (2.76 個月) 評估一次疾病進展。如果使用 TTP 計算樣本量而不考慮生存率,則在不調整區間刪失的情況下達到 80% 功效所需的事件數為 247。在調整了區間刪失並考慮了生存後,所需的事件數約為 390 個,比 247 個增加了 58%!
宏的輸出如下所示

CONCLUSION
本文演示的 SAS 宏在設計時同時考慮了臨床和統計。透過每月的爬坡期、總入組期和每月入組率,臨床運營人員可以規劃啟動多少個研究中心以及何時完成研究中心啟動。或者,臨床作人員可以提供啟動最大入組率和所有研究中心啟動時間。然後,專案統計師可以使用此宏計算總入組期和專案進行最終分析的時間。由於假設入組率從 0 線性增加,因此應調整非線性入組以達到達到精確的預測。爬坡期的開始應該是第一位患者入組的月份,爬坡期的終點應該是入組率穩定的月份。例如,如果一項臨床試驗的第一個中心在 1 月啟動,第一個患者在 2 月入組,所有中心都在 6 月啟動,並且該試驗直到同年 9 月才為公眾所熟知,那麼爬坡期的起點和終點應該是 2 月和 9 月。
使用較少的模擬試驗,例如500,直到估計功率接近所需的功率,可以透過嘗試和錯誤近似ttp或pfs的所需事件。考慮到任何中值和危險比,您可以首先透過一個試驗執行宏,以獲取連續資料所需的事件數量。然後將此數字分別為所需的事件數量和樣本量加倍和三倍。微調樣本量和事件數量,直到估計功率接近預期功率。達到所需精度所需的功率模擬的試驗次數可以從等式(6)得出。
FDA 指出,一些三期臨床試驗功效不足。 例 2 的結果與 FDA 的宣告相呼應。在規劃使用 PFS 作為主要終點的臨床研究時,考慮區間刪失和生存率非常重要。這是由於以下原因:
1。直到下一次預定評估才能觀察到實際進展的實際事件時間。因此,具有不同實際TTP的患者可能具有相同的觀察到的TTP。
2。儘管中位生存期通常比TTP長得多,但大量PFS事件可能是由死亡引起的。假設分別對實際TTP的指數分佈和中位λ1和λ2生存,這很容易表明在進展前發生的死亡的可能性是
λ1/(λ1λ2)。在示例2中,對照組和試驗組分別為20%和24%。
3。如果藥物有效,則在臨床研究中已經表明,生存的改善接近擴充套件的TTP或PFS。參見Rai等(2000)和Petrylak(2004)。換句話說,危險比的生存改善將比TTP小得多。
本文中介紹的宏解決了上述三個問題。儘管指數分佈用於對 TTP 和生存率進行建模,但此宏可以很容易地擴充套件到 Weibull 或其他生存分佈。








REFERENCES
Cytel Inc. (2005), East Version 4 User Manual, Cambridge, MA.
Elashoff, D. (2005), nQuery Advisor Release 6.0 Users Guide, Los Angeles, CA. Hintze, J.L. (2005), PASS User’s Guide – III, NCSS, Kaysville, Utah.
Petrylak, D. (2004), “Docetaxel in HRPC: Data From Recent Randomized Trials,” a presentation made at the Fourth International Prostate Cancer Congress.
Rai, K. R., Peterson, B. L., Appelbaum, F. R., Kolitz J., Elias, L., Shepherd, L., Hines, J., Threatte, G. A., Larson, R. A., Cheson, B. D., Schiffer, C. A. (2000), “Fludarabine Compared With Chlorambucil As Primary Therapy For Chronic Lymphocytic Leukemia,” The New England Journal of Medicine, 343: 1750–1757.
SAS Institute Inc. (1999), SAS/STAT User’s Guide, Version 8. Cary, NC: SAS Institute Inc.
Schoenfeld D.A. (1981), “The asymptotic properties of comparative tests for comparing survival distributions ,”
Biometrika, 68, 316-319.
完結















0則評論