开篇声明:1:以下内容转自以下内容转自微信公众号新药说《BMS临床III期失败》,如有侵权,可联系删除
2. 以下观点,仅代表作者个人观点,请带着质疑的态度去阅读。如有问题,欢迎评论区留言或直接联系作者
BMS临床III期失败
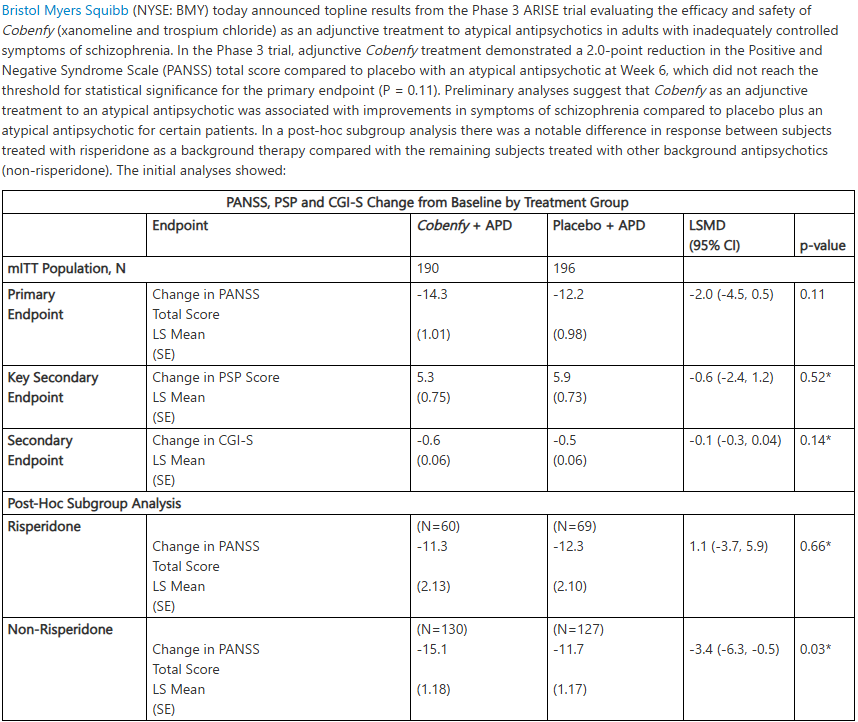
4月22日,百时美施贵宝发布了Cobenfy(xanomeline和trospium chloride)作为非典型抗精神病药物辅助疗法治疗成人精神分裂症的III期ARISE试验的顶线结果。尽管该试验在第6周时PANSS总评分显示出2.0分的降低,但未达到主要终点的统计学意义。
这项为期6周的随机、双盲、安慰剂对照、多中心、门诊研究纳入了对现有抗精神病药物反应不足的成年精神分裂症患者。研究的主要目标是通过阳性和阴性症状量表 (PANSS) 总分 相对于基线的变化来评估Cobenfy作为辅助治疗的疗效。
初步结果显示,与安慰剂加非典型抗精神病药物组相比,接受Cobenfy加非典型抗精神病药物治疗的患者在第6周时PANSS总分降低了2.0分。然而,这一差异并未达到主要终点所需的统计学显著性。
尽管主要终点未达到统计学显著性,但初步分析表明,对于某些患者而言,与安慰剂组相比,Cobenfy作为辅助治疗与精神分裂症症状的改善相关。尤其值得关注的是一项事后亚组分析显示,接受利培酮 (risperidone)作为背景治疗的患者与接受其他背景抗精神病药物(非利培酮类,包括帕利哌酮、阿立哌唑、齐拉西酮、鲁拉西酮和卡利拉嗪)治疗的患者之间存在显著的反应差异。在非利培酮亚组中,Cobenfy组的PANSS总分变化具有统计学意义 (p=0.03),显示出-3.4分的差异。
除了PANSS总分外,该试验还评估了包括个人与社会功能 (PSP) 量表和临床总体印象严重度 (CGI-S) 量表在内的多个次要终点。初步分析显示,在这些次要终点上,Cobenfy 组与安慰剂组之间没有观察到统计学上的显著差异。
Cobenfy 作为辅助治疗的安全性与耐受性与之前的单药治疗试验结果一致。BMS表示将进行进一步的数据分析,并计划与监管机构讨论潜在的后续步骤。 目前正在针对包括阿尔茨海默病和自闭症谱系障碍相关症状、双相情感障碍等多种神经精神疾病推进 Cobenfy 的临床开发项目。
Cobenfy (xanomeline 和 trospium chloride),曾用名KarXT,是一种口服药物,被批准用于治疗成人精神分裂症。它结合了xanomeline(一种优先结合 M1 和 M4 型毒蕈碱受体双重激动剂)和trospium chloride(一种主要在周围组织发挥作用而不易穿过血脑屏障的毒蕈碱受体拮抗剂)。Cobenfy的确切作用机制尚不完全清楚,但其疗效被认为与 xanomeline 在中枢神经系统 M1 和 M4 型毒蕈碱乙酰胆碱受体上的激动活性有关。
完结













0条评论